疾患モデル研究
その5:iPS細胞を利用した疾患モデリングの課題と解決策③
- ゲノム編集の高効率化 -
- ゲノム編集の高効率化 -
ゲノム編集実験の課題
ゲノム編集は、人工的に設計・作製された配列特異的DNA分解酵素を用いてゲノムDNAを切断し、非相同末端結合(NHEJ)や相同組換え(HR)といった細胞が本来有するDNA修復機構を巧みに利用して、ゲノム上の特定遺伝子を改変する技術です(図1)。2013年にCRISPR/Casを利用した第三世代の人工ヌクレアーゼによるゲノム編集が報告されて以来、iPS細胞を用いた疾患モデリングの適用例も多数報告されています。一方で、ゲノム編集をより効果的に行うためには、その実験ステップ毎に解決すべき様々な課題が存在しています(図2)。そのため、ヒトiPSCのゲノム編集に特化した最適化が必要です。
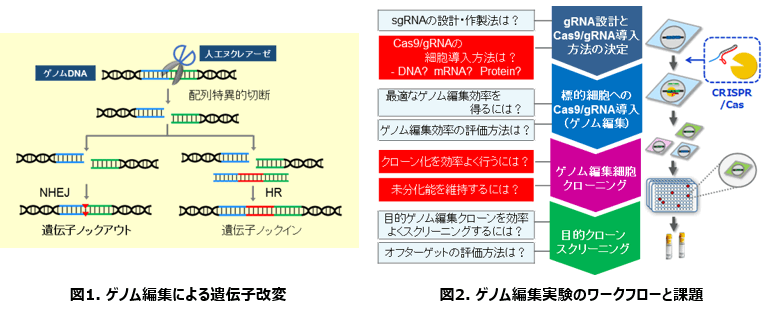
ヒトiPS細胞のゲノム編集における課題
<課題1>目的ゲノム編集細胞のクローン化
オンフィーダー培養に代表される従来のhiPSC培養法では、hiPSCはコロニーとよばれる細胞塊を形成した状態で安定に維持されます。そのため、こうした従来培養法では目的ゲノム編集クローンを選択する際に必要となるhiPSCを単一細胞(シングルセル)化し、未分化性などのhiPSCの特長を安定に保持したまま効率良く拡大培養すること(シングルセルクローニング)は容易ではありませんでした。<解決法1>
最近では、hiPSCのシングルセルクローニングに対応した培養システムの開発が進められています。その例として、DEF-CS培養システムは、他の培養システムよりも高いクローニング効率と未分化性を保持した拡大培養が可能であることが確認されています(図3)。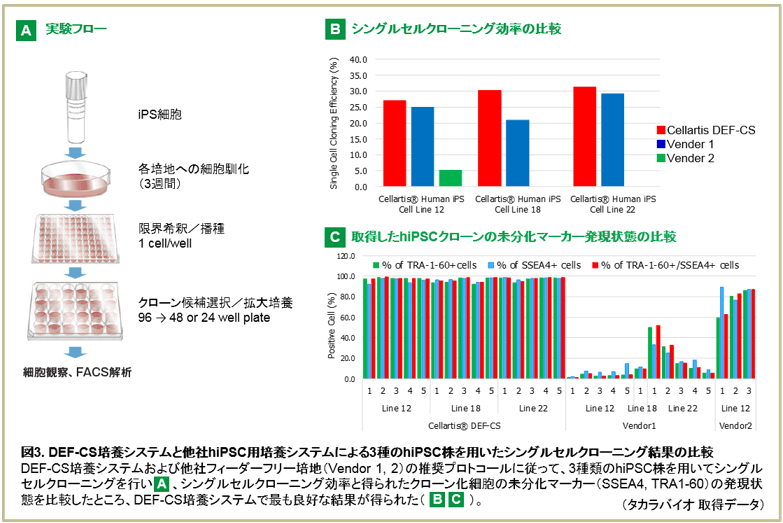
<課題2>人工ヌクレアーゼ導入方法の最適化
目的のゲノム編集細胞を効率よく取得するためには、ターゲット細胞に応じた最適な人工ヌクレアーゼ導入方法の選択とその最適化が必要です。<解決法2>
hiPSCを対象としたゲノム編集においては、Zinc FingerヌクレアーゼやTALEヌクレアーゼなどの従来型の人工ヌクレアーゼの発現プラスミドDNAを、エレクトロポレーション等を用いて導入する方法が一般的に用いられてきました。一方、近年注目されているCRISPR/Cas9由来の人工ヌクレアーゼの場合には、その構造がターゲットに共通なDNA切断機能を有するタンパク質(Cas9タンパク質)とターゲット配列特異的な単鎖RNA(guide RNA:gRNA)から成る複合体(Ribonucleoprotein:RNP)であるという特徴を生かし、オフターゲット効果の低減が期待されるRNPそのものを直接細胞に導入する手法が注目を集めています。RNPのhiPSCへの導入方法としては、エレクトロポレーション(図4)のほか、Gesicleと呼ばれるエキソソーム様小胞(図5)を用いても効果的に導入が可能です。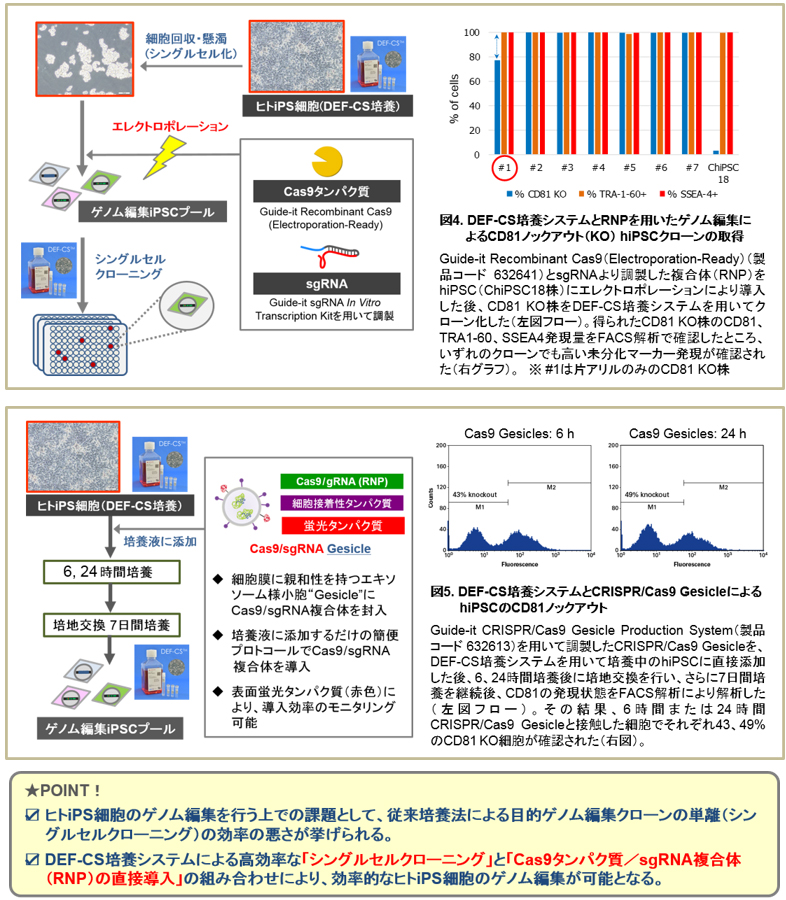
iPS細胞研究は、標準的かつ安全なiPS細胞の作製方法の確立、動物実験による治療効果と安全性の確認など、iPS細胞が発表された2006年と比較すると大きく研究が進展しました。2014年には、iPSCから作った網膜の細胞を移植した臨床研究が始まったほか、最近では患者さんの細胞から作ったiPSC由来の“疾患モデルヒトiPS細胞”を用いて難病治療薬を探索する研究も進んでおり、例えば2017年にはFOP(進行性骨化性線維異形成症)の候補薬の治験が始まりました。
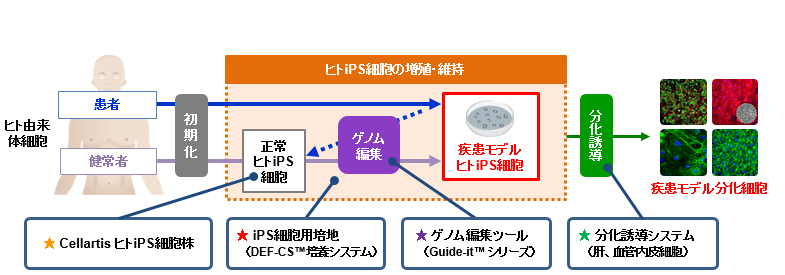
“疾患モデルヒトiPS細胞”は、健常者由来のヒトiPS細胞を初期化し、目的の変異をゲノム編集によって加えることで取得するアプローチ(図6)もあり、この細胞を毒性試験や新薬候補化合物のスクリーニングに活用することで、新しい治療法を開発することが期待されています。
一方で患者さん由来のiPS細胞から作製された“疾患モデルヒトiPS細胞”を用いる研究は、動物細胞を用いる場合などと比較して、ヒトの病気のメカニズムをより忠実に反映したモデルと考えられます。つまり、以前より詳細に「なぜ病気がおこるのか?」という仕組みを知ることができ、病気の進行を止めたり、遅らせたりするような薬剤の探索へ応用することが期待されています。
また、様々な遺伝的背景を持つiPS細胞を樹立することで、心臓や肝臓など、薬の副作用が出やすい臓器の細胞を作製して、薬剤候補化合物を投与し、本来の機能が失われないか(副作用が出ないか)を調べることも出来ます。このような“疾患モデリング”研究は、より多くの患者さんへ新しい治療法を提供することにつながるため、今後もより強力に推進することが望まれます。 タカラバイオではこれからも皆様の“疾患モデリング”研究に役立つ情報・ツールを提供してまいります。
