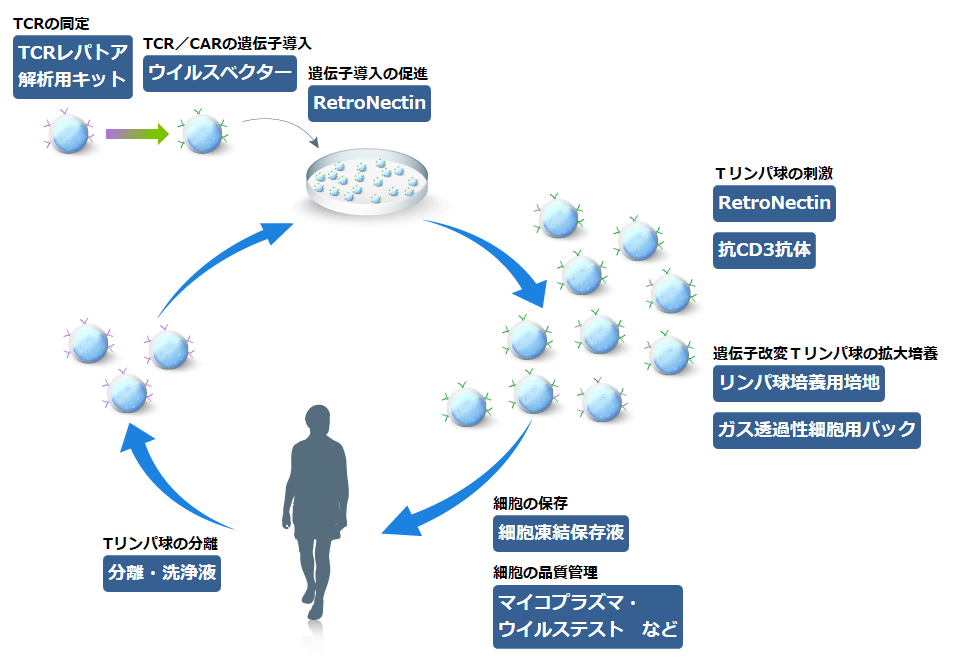
遺伝子改変T細胞の作製・培養
がんを標的とする遺伝子改変T細胞(Tリンパ球)を用いたがん治療法は、従来法では治療が困難ながんにも有望なアプローチとして近年注目されています。本治療法では、がん患者からT細胞を分離し、遺伝子操作によって標的能をもつTCR(T細胞受容体)またはCAR(キメラ抗原受容体)を導入した遺伝子改変T細胞をin vitroで増殖させた後、患者に投与されます。また、これまでに行われた遺伝子改変T細胞を用いた多くの臨床試験において、タカラバイオのRetroNectinが使用されています(参考文献はこちら)。
ここでは、遺伝子改変T細胞の作製・培養のワークフローにおいて、使用実績のある製品をご紹介します。
![]()
分離・洗浄液
全血からの末梢血単核球(PBMC)分離例
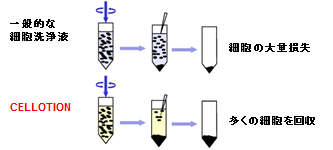
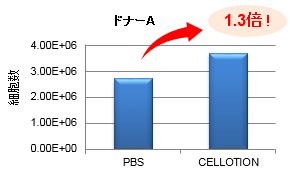
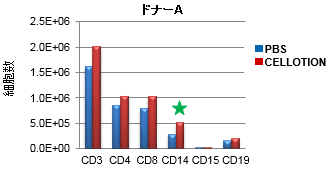
血液からリンパ球や単球を分離採取する試薬とCELLOTIONを併用して、血液からの末梢血単核球分離操作を行った結果、PBS使用時の1.3倍の細胞が回収でき(パネルA)、CD3、CD4、CD8、CD14、CD15、CD19抗原陽性細胞の回収率も増加した(パネルB)。
特にCD14陽性細胞(単球)で高い回収率の向上(★)が認められた。単球は白血球の中でも接着性の高い細胞であることから、通常の回収方法では回収ロスが多く、CELLOTIONを使用することで顕著に回収率が向上したと考えられる。
血液からリンパ球や単球を分離採取する試薬とCELLOTIONを併用して、血液からの末梢血単核球分離操作を行った結果、PBS使用時の1.3倍の細胞が回収でき(パネルA)、CD3、CD4、CD8、CD14、CD15、CD19抗原陽性細胞の回収率も増加した(パネルB)。
特にCD14陽性細胞(単球)で高い回収率の向上(★)が認められた。単球は白血球の中でも接着性の高い細胞であることから、通常の回収方法では回収ロスが多く、CELLOTIONを使用することで顕著に回収率が向上したと考えられる。
【A】 血液3 mlからの回収細胞数

【B】 血液3 mlからの免疫表現型の回収細胞数

TCRレパトア解析用キット
SMARTer® Human scTCR a/b Profiling Kit
SMART-Seq® Human TCR (with UMIs)
SMARTer® RACE 5'/3' Kit
- イルミナ社次世代シーケンサー(NGS、MiSeq推奨)用ライブラリー調製キット
- マルチプレックスPCRに依らず、ヒトTCRmRNAの完全長V(D)Jのシーケンスが可能
- シングルセル解析のため、TCRα鎖、β鎖のペアリング情報を取得可能
- 96個のシングルセルに8種類のインデックスを付加後プール。8個のシングルセルをまとめて
ライブラリー調製できるため、ハイスループットな作業が可能
SMART-Seq® Human TCR (with UMIs)
- イルミナ社NGS用ヒトTCRのレパトア解析ライブラリー調製キット
- 末梢血白血球total RNA 10 ng~1 μg、T細胞total RNA 1~100 ng、全血total RNA 20~200 ng、T細胞 1,000~10,000個から調製可能
- 完全長V(D)J可変領域のシーケンス(MiSeq推奨)やCDR3配列のシーケンス(イルミナ社全シーケンサー)が可能
- 分子バーコード(UMI)やUnique Dual Indexの利用でより正確なNGS解析が可能
SMARTer® RACE 5'/3' Kit
- SMARTer技術を利用して、微量RNAからでも完全な5'末端あるいは3'末端cDNAを取得
- わずか10 ngのtotal RNAからスタート可能
- キメラ抗原受容体発現T細胞(CAR-T細胞)の抗体可変領域のクローニング実績あり
ウイルスベクター

レンチウイルスベクター
- ほぼ全ての哺乳動物細胞へ目的遺伝子の導入と発現が可能
- 長期にわたる遺伝子発現が可能 ウイルスベクター選択ガイド(レンチウイルス、レトロウイルス、アデノウイルス、アデノ随伴ウイルス)についてはこちら
RetroNectin
RetroNectin® GMP grade
- RetroNectinを用いた培養によりT細胞の培養効率が増大し、得られるT細胞集団中にナイーブT細胞(★)が多く含まれる
★ ナイーブT細胞は未分化な細胞で、抗原提示を受けて細胞傷害性T細胞に分化する能力を持つ - レトロウイルスベクターやレンチウイルスベクターによる哺乳動物細胞への遺伝子導入効率を向上
- GMPに準拠した製造・品質管理
- 動物由来成分不含
※ RetroNectin GMP gradeは、2019年3月15日付で、米国食品医薬品局(Food and Drug Administration: FDA)のドラッグマスターファイル(Drug Master File: DMF)に登録されました。
※ RetroNectinを用いたリンパ球拡大培養を研究目的以外で実施する場合には、個別に弊社とのライセンス契約の締結が必要です。
※ RetroNectinを用いたリンパ球拡大培養を研究目的以外で実施する場合には、個別に弊社とのライセンス契約の締結が必要です。
末梢血単核球への遺伝子導入
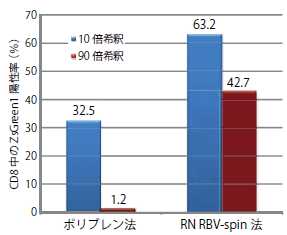
ヒト末梢血単核球(PBMC)にZsGreen1を発現するレンチウイルスベクターをポリブレン法とReroNectin法で導入した。
その結果、ポリブレン法では10倍希釈したレンチウイルスで32.5%の陽性率を示したが、RetroNectinを用いたRBV-Spin法では10倍希釈したウイルスを使用した場合で63.2%もの高い陽性率を示し、また90倍希釈したウイルスを用いても42.7%の高い陽性率が得られた。
RBV-Spin法、ポリブレン法の詳細はこちら
ヒト末梢血単核球(PBMC)にZsGreen1を発現するレンチウイルスベクターをポリブレン法とReroNectin法で導入した。
その結果、ポリブレン法では10倍希釈したレンチウイルスで32.5%の陽性率を示したが、RetroNectinを用いたRBV-Spin法では10倍希釈したウイルスを使用した場合で63.2%もの高い陽性率を示し、また90倍希釈したウイルスを用いても42.7%の高い陽性率が得られた。
RBV-Spin法、ポリブレン法の詳細はこちら
抗CD3抗体

Anti-CD3 mAb GMP grade
- T細胞刺激用抗体OKT3クローン(Isotype: mouse IgG2a)抗体
- GMPに準拠した製造・品質管理
- 動物由来成分不含
- RetroNectinと共刺激することによりTリンパ球(T細胞)を効率よく拡大培養することが可能
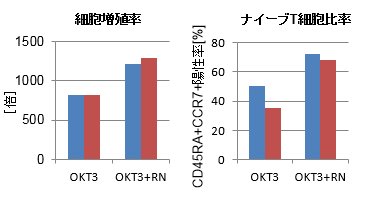
RetroNectin共刺激によるTリンパ球拡大培養
ヒト末梢血単核球(PBMC)を固定化Anti-CD3 mAbとRetroNectin(RN)の共刺激下で4日間培養後、リンパ球培養用培地で適宜希釈しながら、さらに10日間培養を行った。
RetroNectinの使用により、細胞増殖率の向上およびナイーブT細胞比率(CD45RA+ CCR7+陽性細胞比率)の上昇がみられた。
■ donor A ■ donor B
ヒト末梢血単核球(PBMC)を固定化Anti-CD3 mAbとRetroNectin(RN)の共刺激下で4日間培養後、リンパ球培養用培地で適宜希釈しながら、さらに10日間培養を行った。
RetroNectinの使用により、細胞増殖率の向上およびナイーブT細胞比率(CD45RA+ CCR7+陽性細胞比率)の上昇がみられた。
■ donor A ■ donor B
リンパ球培養用培地

LymphoONE® T-Cell Expansion Xeno-Free Medium
- 動物由来成分を含まないXeno-Free培地
- 無血清培養でもヒトTリンパ球の増殖性を維持し、拡大培養に最適
- 抗CD3抗体とレトロネクチンの共刺激による培養により、抗腫瘍活性を発揮するナイーブTリンパ球を多く含む
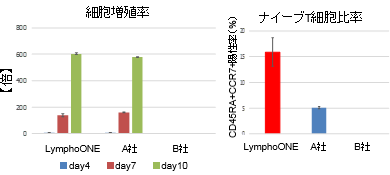
RetroNectin共刺激によるTリンパ球拡大培養(他社培地との比較)
ヒト末梢血単核球(PBMC)をCultiLife 215 Culture bag固定化Anti-CD3 mAbとRetroNectin(RN)の共刺激下で4日間培養後、IL-2を含むリンパ球培養用培地を用い、血清(human AB serum)無添加の条件で10日間培養を行った。
その結果、LymphoONE T-Cell Expansion Xeno-Free Mediumは血清無添加でも安定した細胞増殖性を示し、ナイーブT細胞比率(CCR7+ CD45RA+)が高いことが確認できた。
(弊社取得データ)
ヒト末梢血単核球(PBMC)をCultiLife 215 Culture bag固定化Anti-CD3 mAbとRetroNectin(RN)の共刺激下で4日間培養後、IL-2を含むリンパ球培養用培地を用い、血清(human AB serum)無添加の条件で10日間培養を行った。
その結果、LymphoONE T-Cell Expansion Xeno-Free Mediumは血清無添加でも安定した細胞増殖性を示し、ナイーブT細胞比率(CCR7+ CD45RA+)が高いことが確認できた。
(弊社取得データ)
ガス透過性細胞用バッグ


GT-T610 (CultiLife Eva) Culture bag
CultiLife 215 Culture bag
Partition Clip for CultiLife 215
CultiLife 215 Culture bag
Partition Clip for CultiLife 215
- フラスコよりも高い細胞増殖率を実現
- 閉鎖系培養を可能にし、コンタミネーションおよび培養作業者の感染リスクを低減
- 各種連結ポートにより、容易に液輸送が可能
- 透明性に優れた素材で、容易に顕微鏡観察が可能
細胞凍結保存剤
STEM-CELLBANKER GMP grade
- GMPに準拠した製造管理および品質管理を実施
- 幹細胞・iPS細胞用細胞保存液
- 既知成分により合成された無血清タイプ
- 動物由来の成分を含まない
- DNA、RNAを損傷せず、組織の凍結保存が可能
※ STEM-CELLBANKER GMP gradeは、STEM-CELLBANKERとして原薬等登録原簿(マスターファイル)に登録されています。
マイコプラズマ
ウイルステスト
ウイルステスト
TaKaRa Mycoplasma qPCR Detection Kit
Virus Test Kit
- 第十八改正日本薬局方のマイコプラズマ否定試験に従い検出感度・特異性・頑健性について確認済み
- リアルタイムPCR法により1日で結果判定が完了
Virus Test Kit
- 厚生労働省の指針収載の9種類のウイルスを検出
- B型肝炎(HBV)、C型肝炎(HCV)、ヒト免疫不全ウイルス(HIV)感染症、成人T細胞白血病(HTLV)、パルボウイルスB19感染症
- サイトメガロウイルス感染、EBウイルス感染及びウエストナイルウイルス感染
■CAR-T/TCR遺伝子治療臨床試験におけるRetroNectin GMP gradeの使用例
- T cells expressing an Anti-B-cell maturation antigen chimeric antigen receptor cause remissions of multiple myeloma.
Ali, S. A. et al., Blood (2016) 128: 1688-1700. - CD19-targeted T cells rapidly induce molecular remissions in adults with chemotherapy-refractory acute lymphoblastic leukemia.
Brentjens, R. et al., Science Translational Medicine (2013) ; 5: 177ra38. - Adoptive cell therapy: honing that killer instinct.
Humphries, C. Nature (2013) 504: S13-S15. - B-cell depletion and remissions of malignancy along with cytokine-associated toxicity in a clinical trial of anti-CD19 chimeric-antigen-receptor-transduced T cells.
Kochenderfer, J. N. et al., Blood (2012) 119: 2709-2720. - Immunotherapies: exploiting the immune system for cancer treatment.
Koury, J. et al., J. Immuno. Res. (2018) 585614. - Clinical and immunological responses after CD30-specific chimeric antigen receptor-redirected lymphocytes.
Ramos, C. A. et al., J. Clin. Invest. (2017) 127: 3462-3471. - Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-1.
Robbins, P. F. et al., J. Clin. Oncol. (2011) 29: 917-924. - Myeloid cells in peripheral blood mononuclear cell concentrates inhibit the expansion of chimeric antigen receptor T cells.
Stroncek, D. F. et al., Cytotherapy (2016) 18: 893-901. - Third-generation CD28/4-1BB chimeric antigen receptor T cells for chemotherapy relapsed or refractory acute lymphoblastic leukemia: A non-randomised, open-label phase I trial protocol.
Tang, X. Y. et al.,BMJ Open. (2016) 6: e013904. - Chimeric antigen receptor T-cells for the treatment of B-cell acute lymphoblastic leukemia.
Tomuleasa, C. et al., Front. Immunol. (2018) 19: 239. - Evaluation of γ-retroviral vectors that mediate the inducible expression of IL-12 for clinical application.
Zhang, L. et al., J. Immunother. (2013) 35: 430-439.