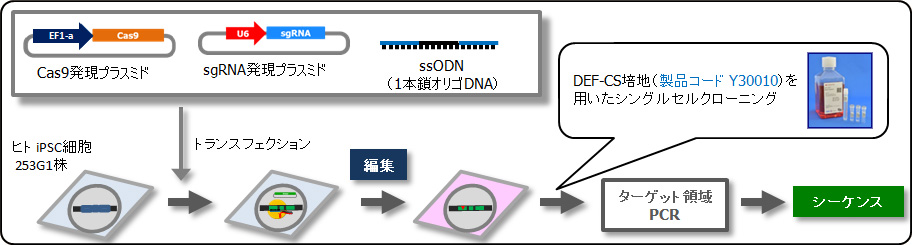
iPS細胞のゲノム編集
- ◆ GMPグレードの組換え型Cas9タンパク質
Recombinant Cas9 Protein GMP grade(製品コード T230)- 現在最も広くゲノム編集に用いられている化膿性レンサ球菌(Streptococcus pyogenes)由来のCas9タンパク質より開発された組換えタンパク質
- 哺乳動物細胞への導入時に生じる細胞へのダメージを低減するように溶液組成を最適化
- 本Cas9タンパク質とガイドRNAを細胞内に導入することで、高効率なゲノム編集が可能
- 医薬品の製造・品質管理基準であるGMPに準拠しており、高い品質を担保
【お客様のご評価結果例 ~他社Cas9タンパク質製品との性能比較~】(下記のデータは、京都大学 iPS細胞研究所(CiRA)臨床応用研究部門 主任研究員/特定拠点講師 堀田秋津先生、および堀田研究室 博士研究員 徐淮耕 先生よりご提供いただきました。)
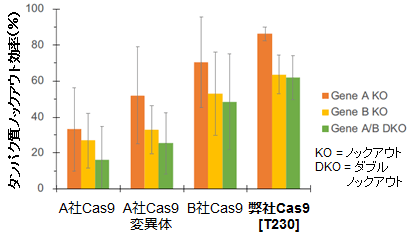 各5 μgのA社Cas9、A社Cas9変異体、B社Cas9、およびRecombinant Cas9 Protein GMP grade と sgRNA(0.625 μg ×2種類)をエレクトロポレーション法によりヒトiPS細胞へ導入することで、2種類の細胞表面タンパク質A(Gene A)、B(Gene B)をそれぞれ別々に、あるいは同時にノックアウトした。その結果得られた細胞の表面タンパク質A、Bの発現をフローサイトメーターで測定し、タンパク質レベルでのノックアウト効率(%)をプロットした(左グラフ)。
各5 μgのA社Cas9、A社Cas9変異体、B社Cas9、およびRecombinant Cas9 Protein GMP grade と sgRNA(0.625 μg ×2種類)をエレクトロポレーション法によりヒトiPS細胞へ導入することで、2種類の細胞表面タンパク質A(Gene A)、B(Gene B)をそれぞれ別々に、あるいは同時にノックアウトした。その結果得られた細胞の表面タンパク質A、Bの発現をフローサイトメーターで測定し、タンパク質レベルでのノックアウト効率(%)をプロットした(左グラフ)。
実験は3回実施し、エラーバーはS.D.(標準偏差)を表す。
結論
弊社のGMPグレードCas9タンパク質は、高いノックアウト効率を安定して示しました! - ◆ iPS細胞へのCRISPR/Cas9ゲノム編集システム
★ ゲノム編集のためのガイドRNAとCas9などを細胞へ導入する3つの方法をご紹介致します。
① エキソソーム様小胞(Gesicle)を用いた導入方法Guide-it CRISPR/Cas9 Gesicle Production System(製品コード 632613)- エキソソーム様小胞(Gesicle)を利用してCas9タンパク質/sgRNAを直接細胞に導入
- トランスフェクション効率が低い哺乳類細胞(分裂細胞、非分裂細胞、iPS細胞)でも効率よくゲノム編集が可能
- Cas9タンパク質/sgRNA複合体が迅速に細胞内から除かれるため、オフターゲットを軽減
Guide-it CRISPR/Cas9 System (Green) / (Red)(製品コード 632601 / 632602)- Cas9 とsgRNAを同時に発現できる便利なワンベクタータイプ
- sgRNA発現用オリゴDNAを準備するだけですぐに使える簡便で迅速なシステム
- マーカーとして蛍光タンパク質(ZsGreen1またはtdTomato)を搭載
AAVpro CRISPR/Cas9 Helper Free System (AAV2)(製品コード 632608)AAVpro CRISPR/SaCas9 Helper Free System (AAV2)(製品コード 632619)- アデノ随伴ウイルス(AAVベクターを用いてCas9、sgRNAを導入
- AAV CRISPR/Cas9の生成に必要な全てのコンポーネントを含んだAll-in-oneシステム
- Cas9のゲノムへの組み込みによる持続的なCas9の発現を排除し、細胞毒性やオフターゲットの影響を軽減
ゲノム編集製品の詳細はこちら【ヒトiPS細胞におけるCD81のノックアウト】iPS細胞のノックアウト効率ならびに未分化維持を、CD81を認識するFITC標識抗体、SSEA4*を認識するPE標識抗体をそれぞれ用い、フローサイトメトリーにより解析した。Cas9/sgRNA Gesicleでの処理により、未分化を維持したまま(パネルD)、約10%のCD81ノックアウトが確認できた。
* SSEA4:iPS細胞の未分化マーカー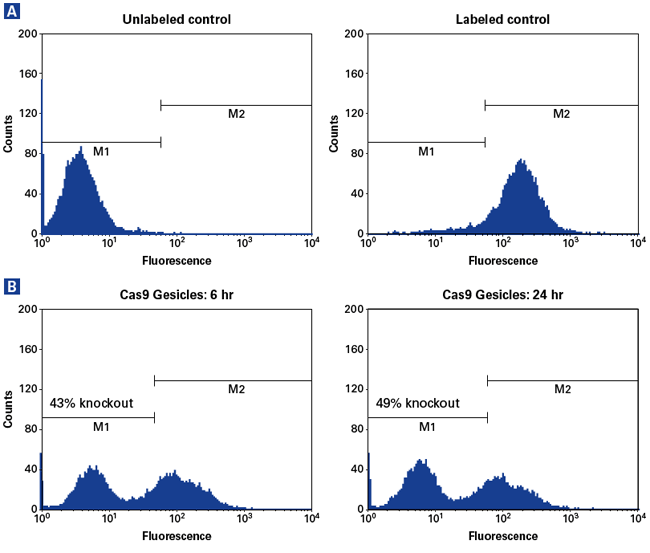 【ゲノム編集ノックインの実施例 ~iPS細胞を用いた鎌形赤血球原因遺伝子のゲノム編集~】
【ゲノム編集ノックインの実施例 ~iPS細胞を用いた鎌形赤血球原因遺伝子のゲノム編集~】
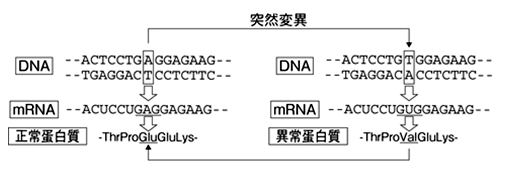 DNA塩基配列がA/TからT/Aに突然変異を起こすと、その結果mRNAが変化し、蛋白質のアミノ酸が1つ変化する。左図の例はヘモグロビンβ鎖蛋白質の6番目のグルタミン酸(Glu)が(Val)に変異して鎌状赤血球貧血症を引き起こす場合を示している。
DNA塩基配列がA/TからT/Aに突然変異を起こすと、その結果mRNAが変化し、蛋白質のアミノ酸が1つ変化する。左図の例はヘモグロビンβ鎖蛋白質の6番目のグルタミン酸(Glu)が(Val)に変異して鎌状赤血球貧血症を引き起こす場合を示している。
sgRNAおよびCas9-EF1α発現プラスミドDNAとssODNをヒト iPS細胞 253G1に導入し、各クローンについて、ゲノムターゲット領域のシーケンスを実施した。101クローンの内、1つノックインされたクローンを獲得できた。 - ◆ iPS細胞のシングルセルクローニング
Cellartis® DEF-CS™ 500 Culture System (製品コード Y30010)- 高効率なシングルセルクローニングに最適
- フィーダーフリー条件下でシングルセルに分散した状態で継代が可能
- 培地と培地添加剤、プレートコーティング剤を含むオールインワンの培養システム
【シングルセルクローニングの効率】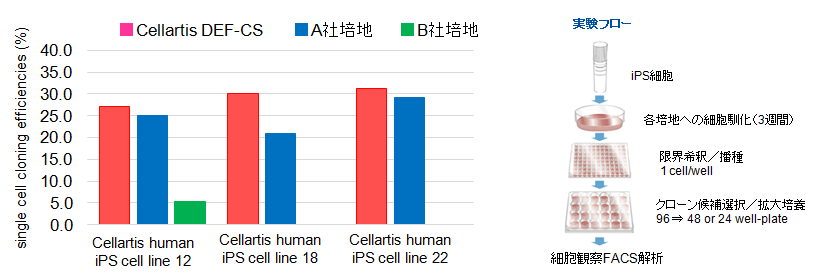
DEF-CSシステムは、3種のiPS細胞株において、他社培地と比較して最も高いシングルセルクローニング効率を示した。 (弊社比較データ)【TRA1-60、SSEA4未分化マーカーの発現確認】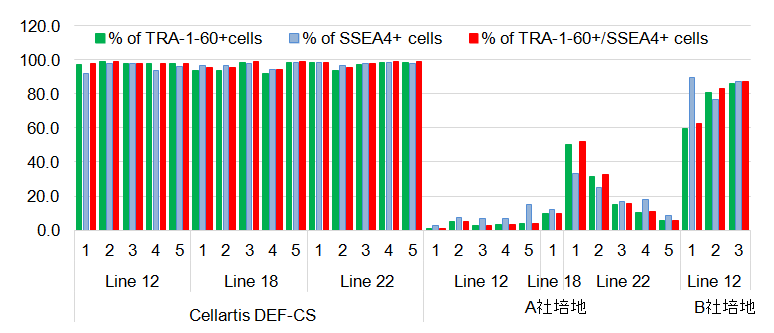
各培地を用いたシングルセルクローニングにて取得したiPS細胞クローン各5個ずつを選択し(クローニング細胞が5個未満の場合は全クローンを選択)、拡大培養後、TRA-1-60とSSEA4の未分化マーカー発現をフローサイトメトリーで解析した。DEF-CSで取得したクローンは、未分化マーカーの高い陽性率と発現強度を示した。一方、他社培地で得られたクローンは、未分化マーカーの発現が一部またはほとんど消失していた。 (弊社比較データ)
結論
Cellartis DEF-CS Culture Systemを用いたヒトiPS細胞のシングルセルクローニングを検討した結果、他社製品と比較して、高効率にiPS細胞のシングルセルクローニングが可能であり、iPS細胞をより安定して増殖させることができた。
さらに、クローニング後のiPS細胞の未分化状態は、Cellartis DEF-CS Culture Systemで高く維持できたが、他社製品では未分化マーカー発現が一部またはほとんど消失していた。 - ◆ ゲノム編集による目的クローンのスクリーニング
Guide-it™ Genotype Confirmation Kit(製品コード 632611)- ゲノム編集後のクローンのジェノタイピングにより、遺伝子型を同定
- 高品質Cas9ヌクレアーゼとsgRNAを用いたin vitro DNA切断反応による簡単ジェノタイピング
- タイピング用DNA断片は細胞の抽出液から直接PCRにより調製
【Cas9/sgRNAのin vitro DNA切断反応による遺伝子型同定の原理】
遺伝子型 クローン化細胞からの増幅配列 Cas9/sgRNAによるDNA切断反応 電気泳動パターン 野生型 
片アレル型 
両アレル型 
 は、Cas9/sgRNAにより認識され、DNA切断反応により完全に切断される。
は、Cas9/sgRNAにより認識され、DNA切断反応により完全に切断される。
 は、ゲノム編集による改変が入っているため、Cas9/sgRNAにより認識できず切断されない。
【実験例:クローン化したゲノム編集細胞(HEK293)のジェノタイピング結果】
は、ゲノム編集による改変が入っているため、Cas9/sgRNAにより認識できず切断されない。
【実験例:クローン化したゲノム編集細胞(HEK293)のジェノタイピング結果】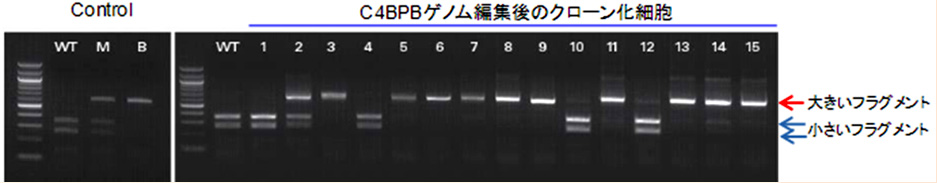
1、4、10、12 のクローンは変異が入っていない野生型(WT)。2のクローンは片アレル変異体(M)、3、5~9、11、13~15 のクローンは両アレル変異体(B)であることが確認できました。
ゲノム編集製品の詳細はこちら