タカラバイオ株式会社は、滋賀県草津市の本社地区に、あらたに再生医療等製品の研究・製造施設を建設し、あわせて同地区の既存の研究・製造施設の拡張を行うことを、本日開催の取締役会において決議しましたのでお知らせします。
なお、総事業費は約73億円を見込んでおり、全額自己資金から拠出する予定です。
当社は、遺伝子・細胞プロセッシングセンターを2014年に、本館棟(新研究棟)を2015年に建設し、自社の遺伝子治療臨床開発プロジェクトの治験薬製造、ならびに再生医療等製品の開発・製造支援事業(以下、CDMO事業)を推進してまいりました。
遺伝子治療臨床開発プロジェクトは順調に推移し、上市を見据えた製造スケールアップを行うステージに達しています。また、CDMO事業においても、製薬企業やバイオベンチャーなどの再生医療等製品の開発プロジェクトの増加やゲノム解析技術の診断分野への拡がりなどの影響を受けて、受託サービスの受注量が増大し、各施設の稼働率が急速に高まっています。
このような状況に対応し、今後の遺伝子治療プロジェクトのさらなる推進とCDMO事業の拡大・発展を目指し、新施設を建設することとしました。
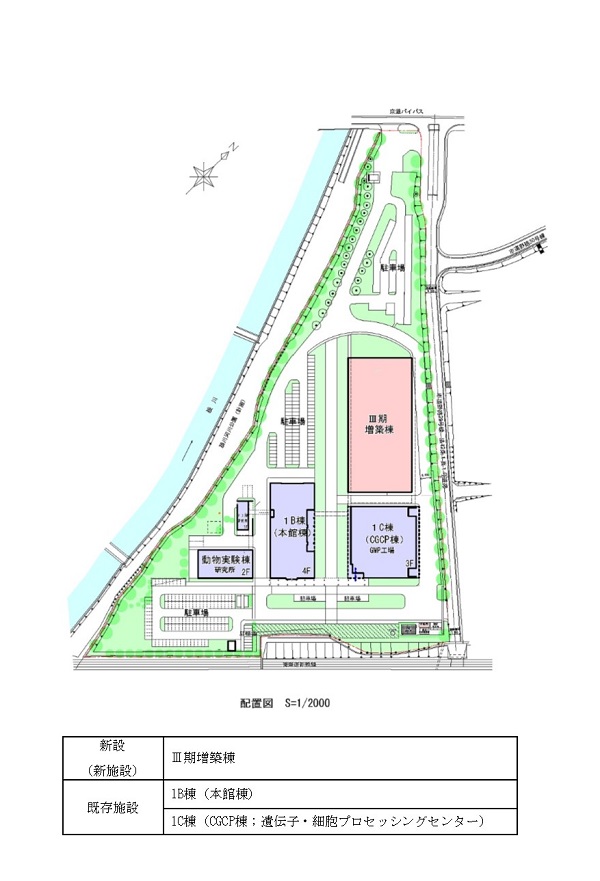
新施設は、GMP/GCTPに準拠した再生医療等製品の製造、品質検査業務、およびゲノム編集やiPS細胞作製などの受託サービス・研究開発業務を行う3つのエリアで構成されます。新施設の増設により、2016年度受託サービス売上実績に対して、実装区域のみで約2.5倍のキャパシティを得ることとなります。
新施設の延床面積は14,100㎡ですが、このうち、約4,600㎡については、未実装区域とし、将来発生するであろう多様なニーズに機動的に対応できる設計となっています。さらに、既存施設の機能の一部を新施設に移管・拡張することに伴い、既存施設の細胞加工やセルバンク保管、さらに高速シーケンサーによる遺伝子解析業務に関連するフロアなども拡張し、これらの機能向上、キャパシティアップも行う計画です。
当社は、「タカラバイオ中期経営計画2019」(2017年5月9日策定)において、「日本初のがんの遺伝子治療薬の承認取得」、「再生医療等製品関連CDMO事業トップランナーの堅持」を経営目標に掲げており、当該施設の新設・改修を機にこれらの事業の一層の発展・強化を進めてまいります。
この件に関するお問い合わせ先 : タカラバイオ株式会社 広報・IR部
Tel 077-565-6970
|
本社地区研究・製造施設の新設ならびに既存施設の拡張 |
|---|
|
所在地 |
滋賀県草津市野路東七丁目4番38号 |
|---|
|
目的 |
|
|---|
|
内容 |
①新棟建設
②既存施設
|
|---|
|
竣工 |
2019年9月予定 |
|---|
|
事業費 |
約73億円(全額自己資金から拠出) |
|---|
|
主な施工会社 |
|
|---|

再生医療等製品
医薬品医療機器等法(2014年11月施行)により医薬品や医療機器とは別に、新たに定義されたカテゴリーで、 従来の再生医療で想定される移植用に加工・調製されたヒトの細胞・組織等に加えて、遺伝子治療製品なども含まれます。
GMP/GCTP
GMP:Good Manufacturing Practiceの略で、医薬品を製造する際に遵守すべき「医薬品及び医薬部外品の製造管理及び品質管理の基準」を指します。GMPは、安全で品質が担保された医薬品を供給するため、医薬品の製造時の管理、遵守事項を各国の規制当局が定めたものです。
GCTP:Good Gene, Cellular, and Tissue-based Products Manufacturing Practiceの略で、「再生医療等製品の製造所における製造管理及び品質管理の基準」を指します。
CDMO事業
Contract Development and Manufacturing Organizationの略です。
再生医療等製品の開発・製造支援サービス業のことを指します。
ベクター
遺伝子治療などを行う際に細胞に治療用の遺伝子を運ぶ(導入)する際に使用します。遺伝子操作等により無毒化したウイルスが使用されます。
遺伝子・細胞プロセッシングセンター
自社の遺伝子治療臨床開発プロジェクトの治験薬製造、CDMO事業の推進を目的として2014年に、滋賀県草津市の本社地区に、国内最大級の再生医療関連施設として竣工しました。3階建て、延床面積約6,500㎡、GMP/GCTPに準拠し、再生医療等安全性確保法(2014年11月施行)の特定細胞加工物製造許可やISO9001認証を取得しています。また、国際製薬技術協会(ISPE)より2016年ファシリティ・オブ・ザ・イヤー(FOYA)のファシリティ・インテグレーション部門賞を受賞し、再生医療のCDMO事業で求められる多品目の再生医療等製品などを安全かつ効率的に製造できる施設として評価を得ています。
タカラバイオが進める遺伝子治療プロジェクトの概要
がんを対象とした遺伝子治療として腫瘍溶解性ウイルスHF10、遺伝子改変T細胞治療(CD19・ CAR、NY-ESO-1 siTCR™)の臨床開発を進めています。主要プロジェクトの進捗状況は下表をご覧ください。

